自然界中的生物分子通常以线性、支化或环状形式存在。其中,环状分子的共价闭合结构能够对其构象空间施加限制,赋予其独特的物理、化学或生物学性质。受大自然启发,化学家们设计并合成了众多具有环状结构的分子(也被称为主体分子),这些主体分子能够通过非共价相互作用( , NCIs)与具有特定结构的客体分子形成主客体复合物( ),从而实现对客体分子理化性质乃至生物学功能的调控。在众多主体分子中,天然存在的环糊精(, CDs)因具有水溶性良好、生物相容性极佳、衍生化容易等优点而吸引了广泛的研究兴趣。
从结构上看,目前研究较多、应用最广的环糊精(α-、β-和γ-CDs)由六到八个D-葡萄糖组成,这些葡萄糖单元之间通过 α -1,4糖苷键相连(图1)。由于分子内氢键和环状结构的存在均限制了葡萄糖单元间C-O单键的自由旋转,因而环糊精可以保持形如截锥体的稳定构象。组成环糊精的所有葡萄糖单元的伯羟基和仲羟基分别位于截锥体的小口端(1° face)和大口端(2° face),而3位和5位的C-H键均指向截锥体内部。这些亲/疏水基团在空间上高度有序的排列导致环糊精两端亲水而空腔疏水,从而使环糊精可以通过疏水作用结合疏水性客体或残基;此外,环糊精两端羟基的进一步衍生化可以改变其水溶性和空腔尺寸等特性,使其能够在水溶液中高选择性地识别和结合包括药物分子在内的众多客体。
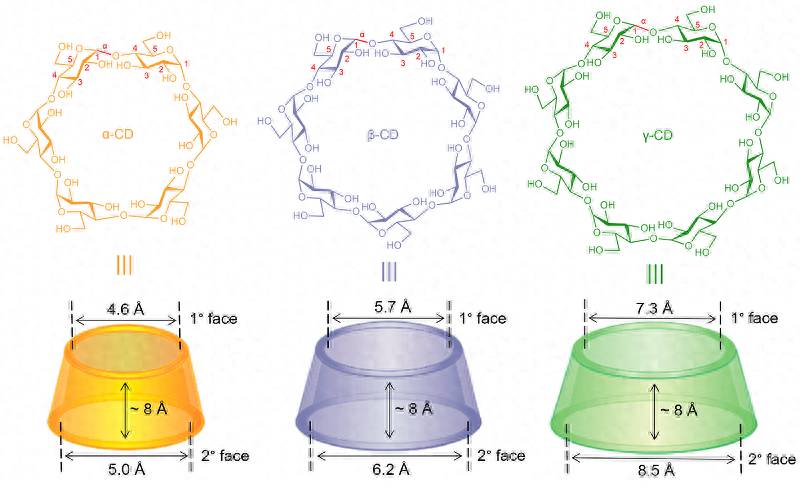
图1. 常见环糊精(α-, β- 和γ-CDs)的化学结构及空腔尺寸。图片来源:Stoddart课题组
纵观环糊精的整个研究和应用历史,发展高效且可规模化制备环糊精及其同系物的方法一直是研究的重点和驱动力之一(图2)。虽然环糊精早在1891年就被法国科学家 意外发现,但相关领域的快速增长却是在近一个世纪之后。这可以部分归因于上世纪七八十年代生物技术的进步,使得通过酶法工业级制备环糊精(α-、β-和γ-CDs)成为可能。近年来,为解决空腔尺寸更小或更大的环糊精的可用性问题,合成化学家们发展了众多新颖的化学或酶法合成策略,完成了多个环糊精同系物的高效制备,这些同系物包括最小环糊精CD3和CD4( , 2019 , 364 , 674-677,点击阅读详细)以及CD5、CD9–CD12等。然而,目前已知的所有环糊精都只由D-葡萄糖组成。考虑到手性主体分子(及其衍生物)的两种对映异构体通常具有不同的物理、化学和生物学(如酶稳定性和受体亲和力等)特性,并对手性客体表现出有差异的识别和结合能力,因而获得仅由L-葡萄糖组成的镜像环糊精构成了该领域一项未被满足的研究需求。
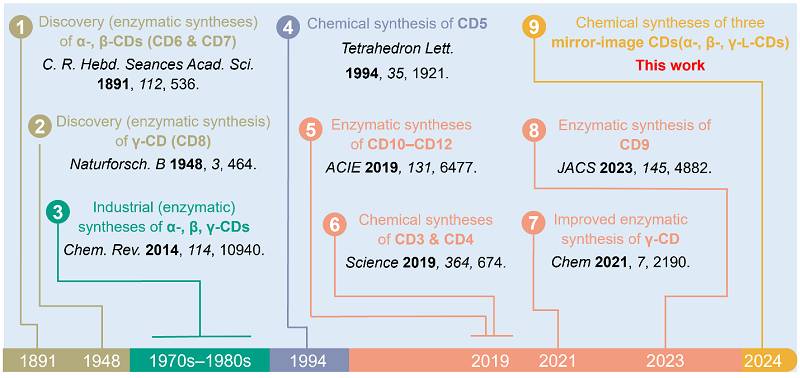
图2. 常见环糊精(α-、β- 和γ-CDs)及其同系物的酶法和化学法合成。图片来源:Stoddart课题组
近日,美国 西北大学 的 J. 教授(2016年诺贝尔化学奖得主之一,现任香港大学化学系讲座教授)以及 德克萨斯大学阿灵顿分校 的 W. 教授合作, 首次报道了三种镜像环糊精的人工合成。 该项工作从市售的L-葡萄糖出发,设计并合成了两种简单易得的单糖供体和受体,实现了多个连续1,2-顺式L-葡萄糖苷键的非对映选择性构建、线性糖链的一釜快速组装以及高效环化,最终完成了α-、β- 和γ-L-CDs的半克级制备。相关论文发表在 上,靠前作者为课题组的 吴勇 博士。
作者首先对α-L-CD进行了逆合成分析(图3a)。全保护的α-L-CD,即环状化合物 1 ,可由线性六糖 2 经分子内糖基化反应(环化)获得,而化合物 2 可以被拆解成两种二糖片段 3 和 4 。采用基于“糖基供体预活化”的糖链组装策略,二糖供体 3 可以与二糖受体 4 通过三组分一釜糖基化反应快速组装成六糖 2 。二糖片段可以进一步拆解成两个单糖砌块 5 和 6 ,化合物 5 和 6 只含有一种端基离去基(对甲苯硫基,STol),可以很方便地从市售的L-葡萄糖大量合成。为了控制糖基化反应中的非对映选择性以获得 α -糖基化产物,单糖砌块 5 和 6 的C-2和C-6位分别安装了无临基参与效应的苄基(Bn)和可远程嵌合辅助的苯甲酰基(Bz),此外,乙醚被选作反应溶剂。在糖基化反应过程中,C-6位Bz的羰基和乙醚上氧原子的孤对电子均可与糖的异头碳相互作用,封堵糖环的 β 面,使得糖基受体(HOR)倾向于从 α 面进攻异头碳,从而选择性构建 α -L-葡萄糖苷键(图3b)。
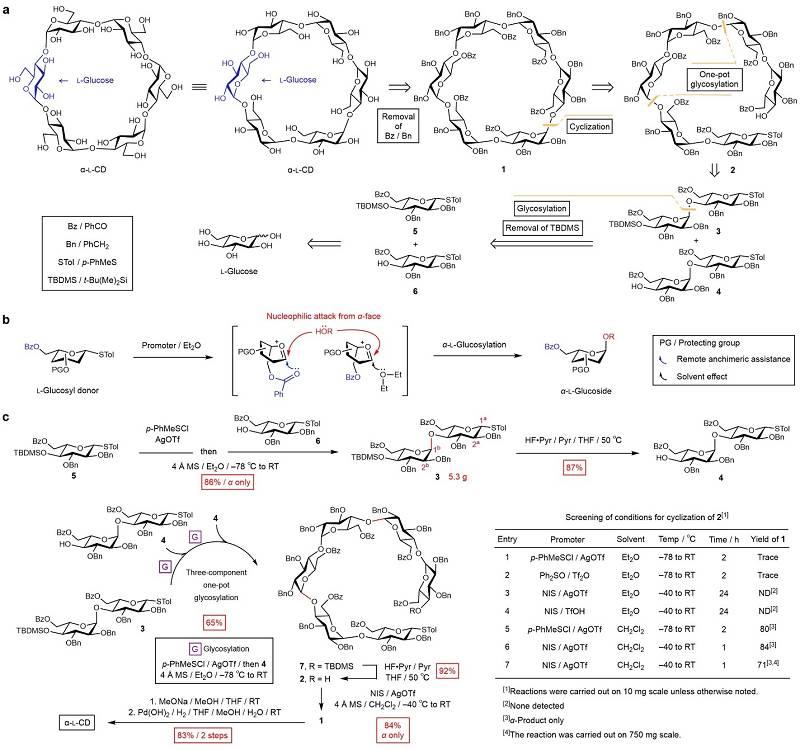
图3. α-L-CD的逆合成分析和化学合成。图片来源: Nat. Synth.
为了验证使用单糖砌块 5 和 6 合成二糖 3 的非对映选择性,作者首先在低温下(–78 ℃)将 5 活化,随后加入 6 ,糖基化反应在缓慢升至室温的过程中完成(图3c)。结果显示,该反应不仅可以选择性生成含一个 α -1,4-L-葡糖糖苷键的二糖 3 ,并且能够放大至数克级。脱除二糖 3 非还原端的临时保护基(TBDMS)后,得到二糖受体 4 。以二糖 3 和 4 为反应物的三组分一釜糖基化反应可以实现六糖 7 的快速组装,脱除TBDMS后,随即得到能发生分子内糖基化(环化)的六糖 2 。对于 2 的环化,作者选择在高度稀释的反应物浓度(0.5 mM)下进行反应,从而最大程度减少分子间糖基化这一副反应。在优化环化反应的过程中,作者发现使用有利于 α -糖基化的乙醚作为溶剂时,无法得到或仅监测到痕量的环化产物 1 。然而,当反应溶剂换成二氯甲烷时,产物 1 的收率可达84%,且未分离到 β -异构体。该环化反应可进一步放大,所得产物 1 经整体去保护,以半克级的规模得到α-L-CD。
完成α-L-CD的高效制备后,作者随后将类似的合成路线应用于β-和γ-L-CDs的化学合成(图4)。首先将六糖 7 与单糖 6 反应,所得的线性七糖 8 先后经临时保护基(TBDMS)脱除和环化,可以以较高收率得到全保护的环状七糖 10 。值得一提的是,化合物 10 的室温1H NMR谱图出现广泛的谱峰宽化(图4b)。变温核磁共振(VT-NMR)实验显示,随着温度的升高,谱峰逐渐变得尖锐。作者推测这一现象与化合物 10 小口端(1° face)的Bz可以动态翻转进出空腔有关(图4c)。在γ-L-CD的合成过程中(图4d),六糖 7 与单糖 6 经三组分一釜糖基化反应得到八糖 11 ,脱除TBDMS后生成化合物 12 。不同于α-和β-L-CDs合成过程中高效的环化反应,化合物 12 的环化更为困难,反应条件经优化后也只能以中等收率(54%)得到全保护的环状八糖 13 。最后,作者分别将化合物 10 和 13 整体去保护,从而完成β-和γ-L-CDs的合成。
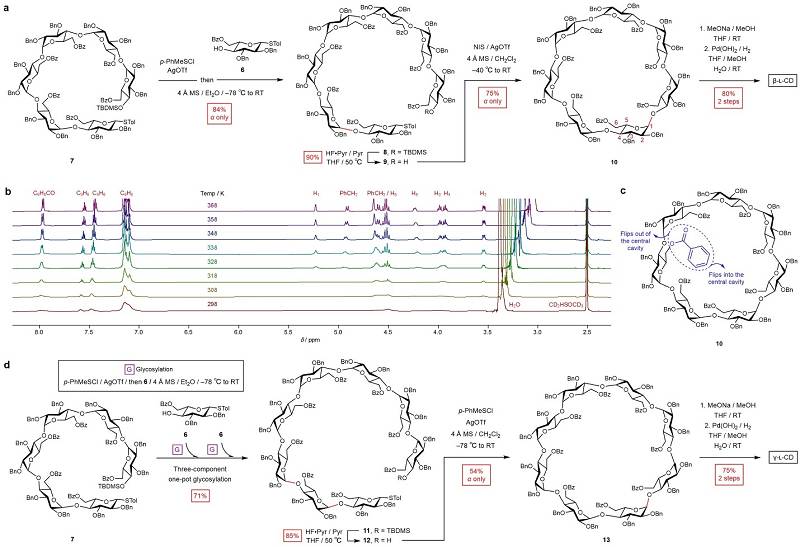
图4. β-和γ-L-CDs的化学合成。图片来源: Nat. Synth.
实现了三种镜像环糊精的高效和半克级制备后,作者不仅通过X-射线单晶衍射和诱导圆二色谱对其固有手性进行了详细表征,还使用1H NMR滴定研究了α-L-CD对天然产物()的两个对映异构体的选择性识别和结合能力。如图5a所示,α-L-CD在水溶液中可与形成2:1的主客体复合物。在1H NMR滴定实验中,随着主体分子α-L-CD的加入,客体分子(+)-(图5b)和(–)-(图5c)上C-10位质子的化学位移逐渐移向低场。通过对化学位移的变化进行拟合,可以得出α-L-CD与(+)-和(–)-的缔合常数分别为672和2808 M–2,说明α-L-CD在水溶液中优先结合(–)-。 镜像环糊精(及其衍生物)这种选择性识别和结合特定手性客体的能力可能使其在手性药物的包合、手性传感和手性催化等方面具有研究价值。
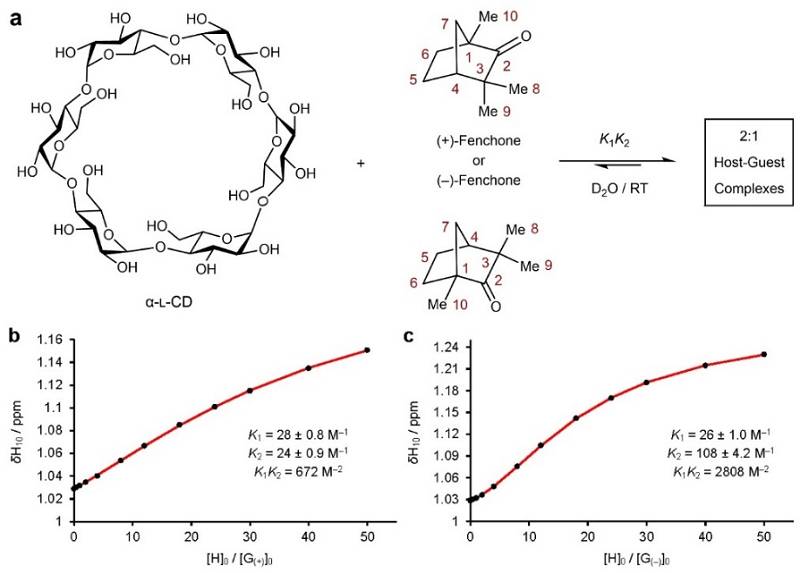
图5. α-L-CD对的手性识别。图片来源: Nat. Synth.
总之,这项工作从简单易得的单糖砌块出发,以至多八步实现了三种镜像环糊精的半克级高效制备,丰富了环糊精研究人员的工具箱,构成了环糊精漫长研究和应用历史中的重要一步。作者预计,由于生物体中的天然酶难以识别镜像环糊精,使其具有比天然环糊精更好的生物稳定性,因而镜像环糊精可能在医药学研究中得到应用。
Mirror-image cyclodextrins
Yong Wu, Saba , Han Han, Chun Tang, Wu, Li, Huang Wu, L. Stern, Guo, Qiu, Aspen X.-Y. Chen, Yang Jiao, Zhang, H. G. David, W. , J. *
Nat. Synth ., 2024 , DOI: 10.1038/s44160-024-00495-8
导师介绍
J. Fraser Stoddart
https://www.x-mol.com///412






